[소셜타임스=정은영 기자]
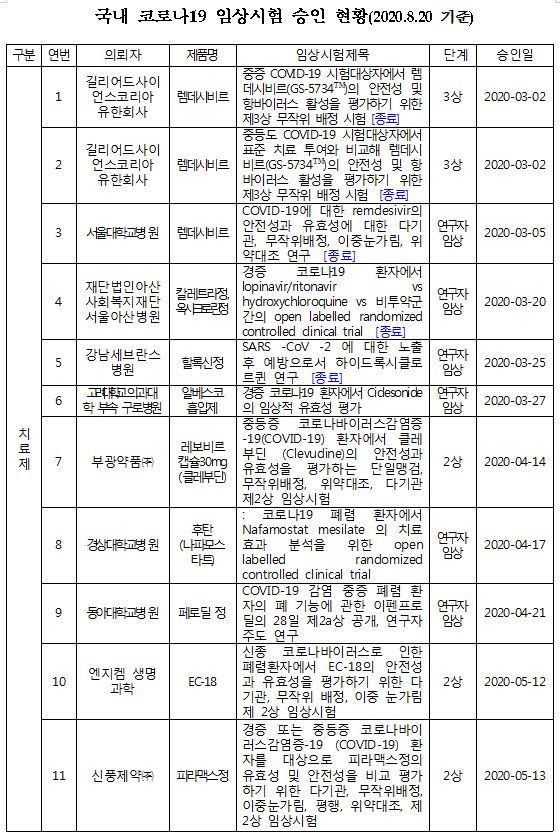
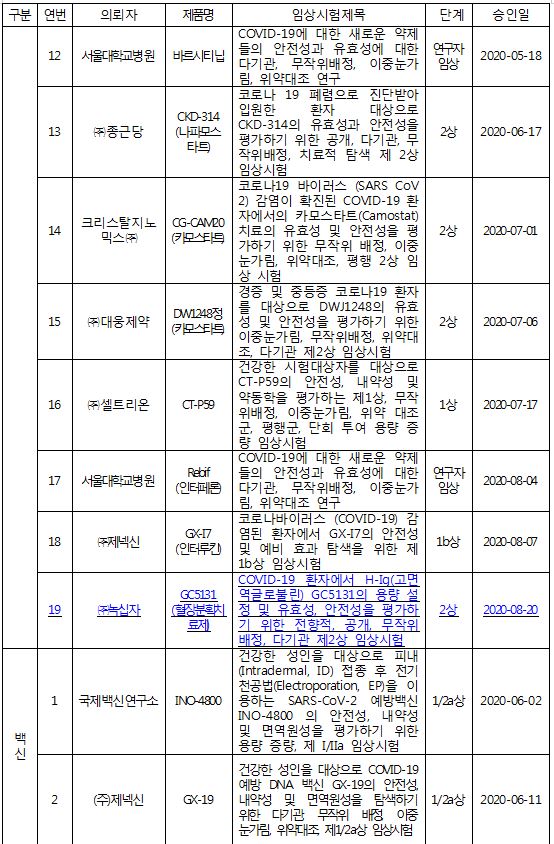
식품의약품안전처는 GC녹십자의 신종 코로나바이러스 감염증(코로나19) 혈장분획치료제 'GC5131'의 2상 임상시험을 20일 승인했다고 밝혔다.
기존에 허가된 의약품의 코로나19 치료 효과를 확인하는 '약물재창출연구' 외에 개발 중인 코로나19 치료제 중 임상 2상을 승인받은 것은 이번이 처음이다.
이로써 국내에서 코로나19 관련해 진행 중인 치료제 및 백신의 임상시험은 총 16건(치료제 14건, 백신 2건)이 됐다.
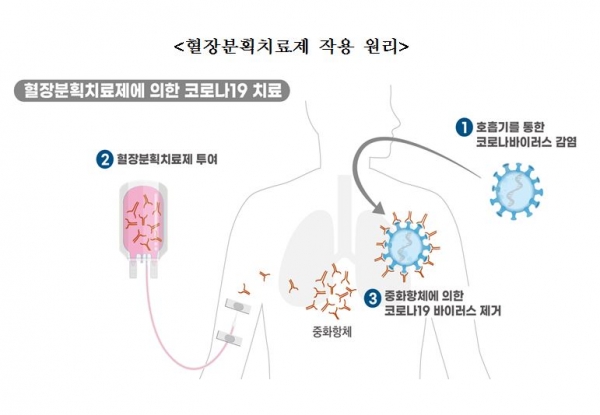
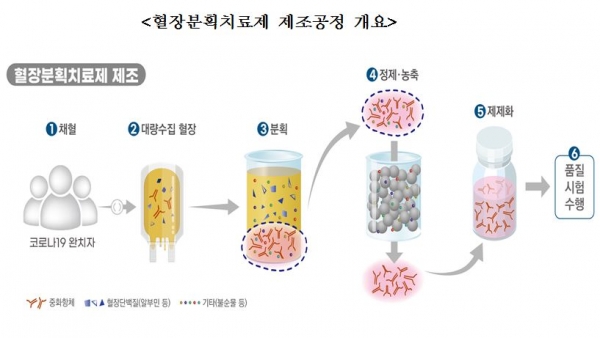
GC5131은 코로나19 완치자의 혈장을 대량으로 수집한 후 여러 공정을 거쳐 코로나19 바이러스를 무력화할 수 있는 중화항체를 농축한 '고면역글로불린'(Hyper-immune Globulin) 성분 의약품이다.
북임상2상 시험에서 코로나19 환자 중 영상학적 진단으로 폐렴이 확인됐거나 고령 및 기저질환이 있는 고위험군 환자 60명을 대상으로 안전성과 유효성을 평가한다.
식약처는 GC5131의 원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발되어 사용되고 있어 임상 1상 시험을 면제했다.
프랑스, 중국, 일본, 이탈리아 등 해외에서도 혈장 치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중이다.
GC녹십자는 이미 임상시험용 제제를 만들었기에 가까운 시일 내 환자에 투여할 수 있을 것이라고 설명했다. 임상은 삼성서울병원, 서울아산병원, 중앙대병원, 고대안산병원, 충남대병원, 연대 세브란스병원 등 6개 병원에서 시행될 예정이다.
GC5131의 임상시험과 상용화를 위해서는 완치자 혈장 확보가 필수적이다. 이날 기준 혈장 공여를 신청한 코로나19 완치자는 1,209명, 실제 채혈을 완료한 완치자는 893명이다.