[소셜타임스=채동하 기자]
식품의약품안전처는 8일 대웅제약이 개발한 코로나19 치료제 ‘DWRX2003’에 대해 1상 임상을 승인했다고 밝혔다.
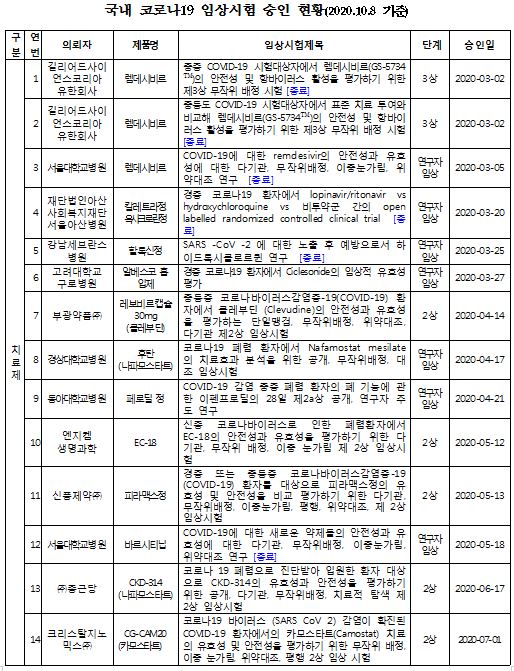
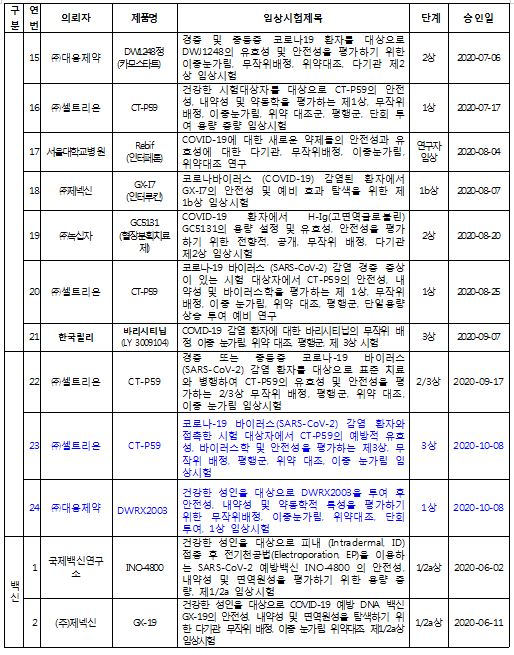
현재 국내에서 코로나19 관련해 임상시험이 진행 중인 치료제 및 백신은 치료제 18건, 백신 2건 총 20건이다.
이번 임상시험은 건강한 성인을 대상으로 ‘DWRX2003’의 내약성, 안전성을 평가하기 위한 1상 임상시험이다.
임상 1상은 최초로 사람에게 투여해 안전성, 약동학 등을 평가하게 되며, 임상 2상은 1상 종료 후, 대상 환자들에게 투여해 치료 효과를 탐색한다. 마지막 단계인 임상 3상은 2상 종료 후, 많은 환자들에게 투여해 안전성과 치료효과를 확증하는 단계이다. 긴급한 차료제의 경우 ‘1상과 2상’ (1/2상) 또는 ‘2상과 3상’(2/3상)을 동시 승인하는 경우도 있다.
임상시험약인 ‘DWRX2003’는 현재 구충제로 사용되고 있는 성분(니클로사미드)이다. 경구투여 시 체내 흡수율이 낮다는 단점을 대웅제약은 체내 흡수율을 높이기 위해 근육주사제로 개발했다.
치료원리는 바이러스 등에 감염된 세포를 제거하는 자가포식(autophagy) 작용을 활성화해 바이러스 증식을 억제하는 방식이다.
‘DWRX2003’는 인도에서 건강한 사람을 대상으로 8월부터 임상시험을 진행 중에 있고, 필리핀에서는 코로나19 환자를 대상으로 한 임상시험이 승인돼 9월부터 진행 중이다.
또한, 국외에서도 미국 F社와 터키 I社가 경구용 니클로사미드를 이용해 코로나19 환자를 대상으로 한 임상시험을 진행하고 있다.
식약처 관계자는 “코로나19 치료제·백신 개발 제품의 임상시험 현황에 대해서 신속하게 정보를 전달하겠다”며 “안전하고 효과 있는 코로나19 치료제·백신이 신속히 개발될 수 있도록 필요한 사항을 지원할 계획”이라고 말했다.